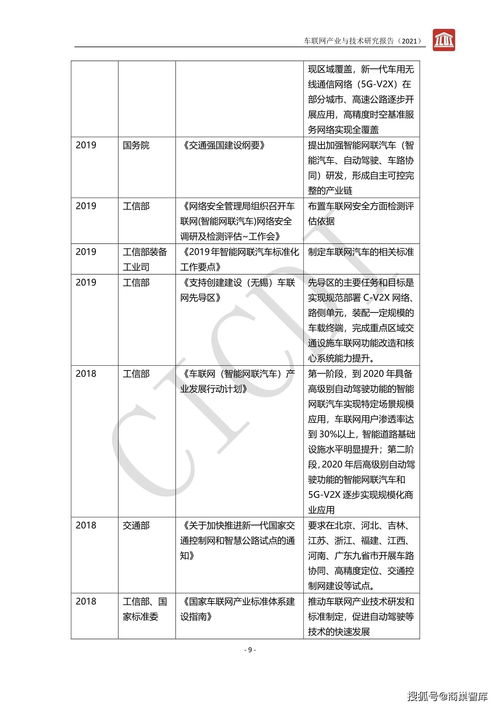
近期,備受業界關注的臨床試驗階段生物制品藥學變更指南正式發布,標志著生物制藥領域在工程和技術研究方面邁出了重要一步。該指南旨在規范和指導生物制品在臨床試驗階段的藥學變更管理,確保變更的科學性、合規性和安全性,從而加速新藥研發進程。
生物制品因其復雜性和特殊性,在研發過程中常需進行藥學變更,如生產工藝調整、質量控制方法優化等。這些變更可能影響產品的安全性、有效性和一致性,因此需要嚴格的管理框架。新指南詳細闡述了變更的分類、評估流程和文檔要求,強調了基于風險的方法,幫助研發機構在變更決策中平衡創新與風險。
指南的出臺將極大促進工程和技術研究的發展。通過提供清晰的技術路徑,它鼓勵企業采用先進的生產技術和分析方法,推動工藝優化和規模化生產。這不僅有助于縮短臨床試驗周期,降低研發成本,還能提升生物制品的整體質量水平,為患者提供更安全有效的治療選擇。
這一指南的實施將強化生物制品研發的規范化管理,助力工程和技術研究與試驗發展邁向新高度。未來,隨著更多創新技術的應用,生物制藥領域有望迎來更多突破性進展。